気体の性質過去問傾向
気体の性質については、乙種化学の学識にて出題される分野です。2012年からの過去の12年分から出題傾向をまとめました。気体に関しての出題はボイル・シャルルの法則、理想気体の状態方程式、ドルトンの分圧法則が多く出題されています。理想気体に関する問題は公式が比較的暗記しやすく、計算も複雑なものは少ないです。年によっては、2問出題されます。
| 項目 | 出題数 |
| ボイル・シャルルの法則 | 5 |
| 理想気体の状態方程式 | 5 |
| ドルトンの分圧法則 | 5 |
| 臨界 | 1 |
練習問題
ここでは、理想気体の分野における基本的な用語や知識に関する問題を掲載しています。問1~3は理想気体に関する基本的な公式を確認する問題です。問4~11は過去に複数回出題された内容に関する内容です。
次の各問について、適切な語句や意味を答えなさい。
P:Pressure(圧力)、V:Volume(体積)、n:物質量、R:気体定数8.314[J/(mol・K)] = 8.314×103[Pa・L/(mol・K)]、T:Temparature(温度)
1m3 = 1000L、1MPa=1.0×106Pa、1kMPa=1.0×103Pa、T(K)=t(°C)+273(K)
上記は問題文には記載されていません。しかしながら、問題を回答するにあたって必要な知識ですので必ず覚えてください。
問1.ボイルの法則の公式を答えなさい。圧力:P、体積:V、温度:Tとする。
解答:PV = 一定
問2.シャルルの法則の公式を答えなさい。圧力:P、体積:V、温度:Tとする。
解答:V/T = 一定
問3.理想気体の状態方程式の公式を答えなさい。圧力:P、体積:V、温度:T、アボガドロ数:R、物質量:n
解答:PV = nRT
問4.温度一定の条件下、圧力1.0MPa、体積5.0Lの理想気体Aを圧力4.0MPaにすると、体積はおよそいくらになるか。
解答:V2 = 0.8 (L)
ボイルの法則より、P1V1=P2V2なので、
P1=1.0(MPa)、V1=5.0(L)、P2=4.0(MPa)を代入して
1.0 × 5.0 = 4.0 × V2
⇄ V2 = 4.0 ÷ 5.0
⇄ V2 = 0.8 (L)
問5.圧力一定の条件下、温度27°Cにおいて体積10Lの理想気体Aを温度227°Cにすると、体積はおよそいくらになるか。
解答:V2 = 16.67 (L)
シャルルの法則より、V1/T1 = V2/T2なので、
V1=10.0(L)、T1=300.0(K)、T2=500.0(K)を代入して
10.0 ÷ 300.0 = V2 ÷ 500
⇄ V2 = 10.0 ÷ 300.0 × 500.0
⇄ V2 = 16.67 (L)
問6.分子量32の理想気体Aを64kg、分子量44の理想気体Bを22㎏を混合した気体がある。気体Aの分圧が40kPaのとき、全圧はおよそいくらか?
解答: PB = 10×103
この問題ではそれぞれの圧力を求めてから、圧力を足すことで全圧が求められます。
理想気体A、Bの圧力をそれぞれPA、PBとすると問題文からPB = 4.0×103 (Pa)となります。また、理想気体A、Bの物質量をそれぞれMA、MBとすると
MA = 64×103 ÷ 32 = 2.0×103 (mol)
MB = 22×103 ÷ 44 = 0.5×103 (mol)
ドルトンの分圧の法則より
MA:MB = PA:PB
⇄ 2.0×103:0.5×103 = 40×103:PB
⇄ 0.5×103 × 40×103 = 2.0×103 × PB
⇄ PB = 10×103
問7.3Lの容器の中に、22gの理想気体Aが圧力2.0MPa、温度27°Cで存在する。理想気体Aの分子量を求めなさい。
解答:0.915 g/mol
P=2.0×106、V=3.0、T=300(K)とし、物質量n=物質の量m/分子量Mなので、n=22/Mとすると
理想気体の状態方程式にPV=nRTに代入して
2.0 × 106 × 3.0 = 22/M × 8.314×103 × 300
⇄ M = 22 × 8.314×103 × 300 ÷ 2.0×106 ÷ 3.0
⇄ M = 0.9145 (g/mol)
問8.27℃、3.0MPaで3Lを占める酸素の物質量を求めよ。
解答:24.0 mol
P=3.0×106、V=3.0、T=300(K)、物質量nを理想気体の状態方程式にPV=nRTに代入して
3.0 × 106 × 3.0 = n × 8.314×103 × 300
⇄ n = 2.0×106 × 3.0 ÷ 8.314×103 ÷ 300
⇄ n = 24.0 (mol)
問9.圧力2.0MPa、温度77°C、物質量4.5molの理想気体が占める体積はいくらか求めなさい。
解答:0.56 L
P=2.0×106、T=350(K)、n=4.5を理想気体の状態方程式にPV=nRTに代入して
2.0 × 106 × V = 4.5 × 8.314×103 × 300
⇄ V = 4.5 × 8.314×103 × 300 ÷ 2.0×106
⇄ V = 0.561 (L)
問10.3Lの容器の中に57℃における16gの酸素がある。圧力を求めなさい。
解答:4.6×105 Pa
V=3.0、T=350(K)、n=16/32を理想気体の状態方程式にPV=nRTに代入して
P × 3.0 = 16/32 × 8.314 × 330
⇄ P = 0.5 × 8.314×103 × 330 ÷ 3.0
⇄ P = 457×103 (Pa)
問11.1Lの容器の中に圧力5.0MPaの窒素が56gある。温度を求めなさい。
解答:2927°C
P=5.0×106、V=5.0、n=56/28を理想気体の状態方程式にPV=nRTに代入して
5.0×106 × 1.0 = 56/28 × 8.314×103 × T
⇄ P = 5.0×106 × 1.0 ÷ 8.314×103 ÷ 2.0
⇄ V = 3000 (K)
演習問題
問1 理想気体Aが2.0MPaの圧力、30°Cで存在する。温度を100°Cにした時の圧力はおよそいくらになるか。
ボイルの法則より、P1V1=P2V2なので、
P1=1.5(MPa)、V1=5.0(L)、P2=3.0(MPa)を代入して
1.5 × 5.0 = 3.0 × V2
⇄ V2 = 1.5 × 5.0 ÷ 3.0
⇄ V2 = 2.5 (L)
問2 1.5MPaで体積5.0Lの理想気体Aを、温度一定で3.0MPa にすると体積はおよそいくらになるか。
シャルルの法則より、V1/T1 = V2/T2なので、
V1=10.0(L)、T1=300.0(K)、T2=500.0(K)を代入して
10.0 ÷ 300.0 = V2 ÷ 500.0
⇄ V2 = 10.0 ÷ 300.0 × 500.0
⇄ V2 = 16.67 (L)
問3 一定圧力下で37℃、体積4.0Lの理想気体を、温度を180℃まで上げると気体の体積はおよそいくらになるか。
シャルルの法則より、V1/T1 = V2/T2なので、
V1=4.0(L)、T1=310.0(K)、T2=453.0(K)を代入して
40.0 ÷ 310.0 = V2 ÷ 453.0
⇄ V2 = 4.0 ÷ 310.0 × 453.0
⇄ V2 = 2.737 (L)
問4 温度10°C、圧力1.0MPa、体積2.0Lの理想気体Aがある。温度を127°C、体積を3.5Lとすると圧力はいくらになるか。
ボイル・シャルルの法則より、P1V1/T1 = P2V2/T2なので、
P1=1.0(MPa)、V1=2.0(L)、T1=283.0(K)、V2=3.5(L)、T2=400(K)を代入して
1.0 × 5.0 ÷ 283.0 = P2 × 3.5 ÷ 400.0
⇄ P2 = 1.0 × 5.0 ÷ 283.0 × 400.0 ÷ 3.5
⇄ P2 = 2.019 (L)
問5.分子量が44の気体の温度が27℃で、容器内の圧力が7.5MPaであった。この時の容器内の気体の密度d(g/L)を求めなさい。
解答:密度d=132 (g/L)
密度d=質量(g)/体積(L)
理想気体の状態方程式より、![]()
圧力P=7.5×106(Pa)、分子量M=44(g/mol)、R=8.31×103(Pa•L/K•mol)、T=300(K)
上の各々の値を代入して計算すると、![]()
= 132.306
問6.温度27°C、圧力1.0MPaで気体の密度が1.5kg/m3であるとき、そのモル質量はいくらか求めなさい。
解答:3.74g/mol
密度![]() より
より![]()
![]() にP=1.0×106Pa、T=8.314×103(Pa•L/K•mol)、T=300(K)、d=1.5(g/m3)を代入して
にP=1.0×106Pa、T=8.314×103(Pa•L/K•mol)、T=300(K)、d=1.5(g/m3)を代入して
M = 1.5 × 8.314×103 ×300 ÷ 1.0×106
= 3.7413
問7.3kmolの窒素が、温度127°C、圧力1.0MPaで容器にある。ある日温度27°C、圧力0.5MPaになっていた。容器から抜けた窒素は何kgであるか。
解答:28kg
最初の状態をα、窒素が抜けた状態βとすると理想気体の状態方程式より
PαV=nαRTα・・・①
PβV=nβRTβ・・・②
容器の大きさは一緒なので①÷②より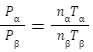
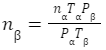 となる。nα=3×103mol、Pα=1.0×106、Tα=400(K)、Pβ=0.5×106Pa、Tβ=300(K)を代入して
となる。nα=3×103mol、Pα=1.0×106、Tα=400(K)、Pβ=0.5×106Pa、Tβ=300(K)を代入して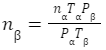 = 3×103 × 0.5×106 × 400 ÷ 1.0×106 ÷ 300
= 3×103 × 0.5×106 × 400 ÷ 1.0×106 ÷ 300
= 2×103mol
容器から抜けた窒素MN2は
MN2 = 28 × (3×103 – 2×103)
= 28×103
問8.5m3の容器に充填した酸素:窒素のモル比が3:1の混合ガスが25°Cで10MPa(絶対圧力)で存在する。この混合ガスが理想気体であるとして、この混合ガスの物質量はいくらか求めなさい。
解答:20.2kmol
理想気体の状態方程式よりn = PV/RT
n = 10×106 × 5 ÷ 8.314 ÷ 298
= 20181.048
問9.分子量56g/molの理想気体が温度27°C、圧力1.2MPaで容器に密閉されている。容器温度一定のまま、中の気体を1.0kg取り出したところ、圧力は0.5MPaとなった。最初に充填されていた気体の質量はいくらか求めなさい。
解答:1.71 kg
最初の状態をα、窒素が抜けた状態βとすると理想気体の状態方程式より
PαV=mα/MRT・・・①
PβV=mβ/MRT・・・②
①-②とすると
V(Pα – Pβ) = RT/M (mα – mβ)
V = RT(mα – mβ)/M(Pα – Pβ)
= 8.314×103 × 300 × 1.0×103 ÷ 56 ÷ (1.2-0.5)×106
= 63.6275 (L)
= 1.2 ×106 × 63.6 × 56 ÷ 8.314×103 ÷ 300
= 1.713×103



コメント